SO2 là loại khí xuất hiện phổ biến trong cuộc sống của chúng ta. Việc nghiên cứu, giảm tác hại của nó trong bầu khí quyển, sản xuất và sử dụng vào các mục đích công nghiệp thực sự cần thiết. Bạn có biết cách điều chế SO2 trong phòng thí nghiệm, công nghiệp được thực hiện như thế nào hay không?
Quy trình điều chế SO2 bao gồm điều chế trong phòng thí nghiệm và trong công nghiệp. Hãy cùng tìm hiểu chi tiết về từng phương pháp nhé!
1. Điều chế SO2 trong phòng thí nghiệm
Đặc tính của SO2 là chất khí không màu, có mùi hắc nhẹ, tan được trong nước và nặng hơn không khí.
Trong phòng thí nghiệm, khí SO2 thu được bằng phương pháp đẩy không khí. Điều chế SO2 bằng cách cho muối Sunfit tác dụng với axit mạnh như HCl, H2SO4.
Cụ thể như sau:
PTHH: Na2SO3 + 2HCl → 2NaCl + H2O + SO2
Trong đó: Na2SO3 là: Natri Sunfit; HCl: Axit Clohidric, NaCl: Natri Clorua
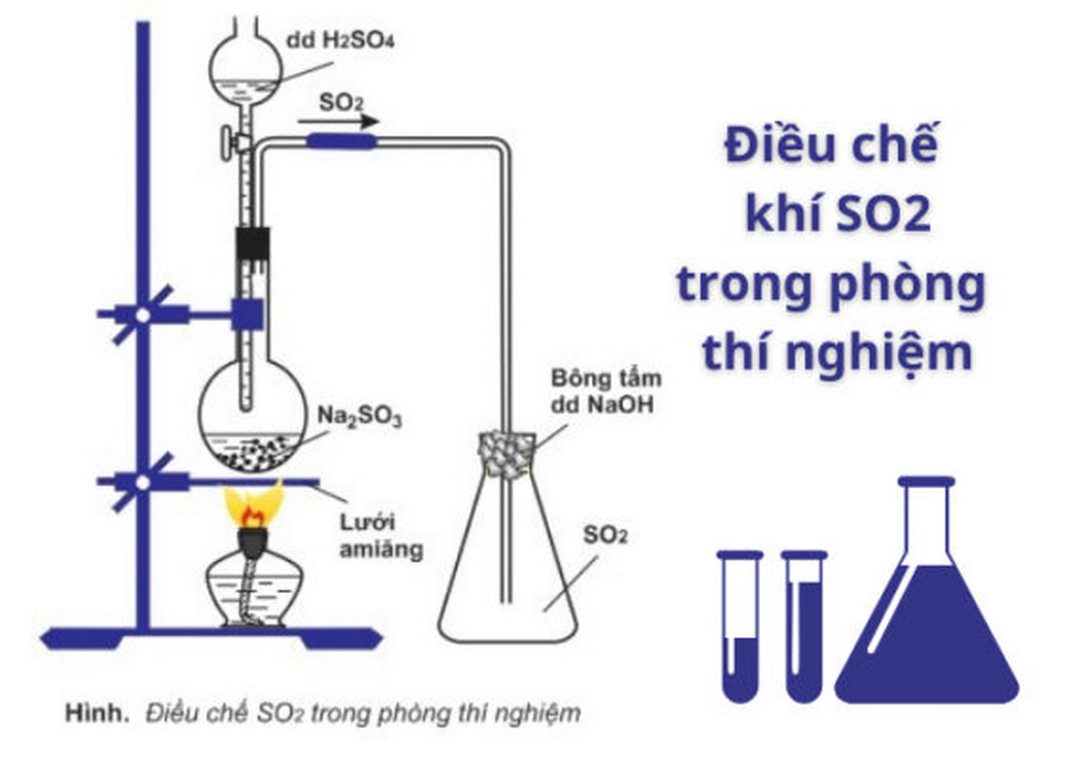
Hoặc phương pháp thu được SO2 trong phòng thí nghiệm theo phương trình sau:
PTHH: Na2SO3 + H2SO4 → Na2SO4 + H2O + SO2
Trong đó: H2SO4 là: Axit Sunfuric và Na2SO4 là Natri Sunfat
Bên cạnh đó, khí SO2 còn được điều chế bằng cách cho Cu tác dụng với H2SO4 đặc.
PTHH: Cu + 2H2SO4đặc → CuSO4 + SO2 + 2H2O
Trong đó, CuSO4 là: Đồng (II) Sunfat
2. Điều chế SO2 trong công nghiệp
Đốt cháy lưu huỳnh:
PTHH: S + O2(to) → SO2
Đốt cháy Hidro Sunfua H2S trong môi trường có oxi dư:
PTHH: 2H2S + 3O2 → 2H2O + 2SO2
Cho kim loại phản ứng với axit H2SO4 đặc nóng:
PTHH: Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
Đốt cháy mẫu quặng pirit sắt:
PTHH: 4FeS2 + 11O2 → 2Fe2O3 + 8SO2
Trong đó, FeS2 là: Pirit sắt, Fe2O3: Sắt (III) Oxit

3. Cách nhận biết khí SO2
Cách 1: Dùng dung dịch Brom – Br2: khí SO2 sẽ làm nhạt màu đỏ nâu của dung dịch Br2
PTHH: SO2 + Br2 + 2H2O → H2SO4 + 2HBr
Trong đó: HBr là Hidro Brom
Cách 2: dung dịch KMnO4: SO2 làm màu dung dịch thuốc tím bị nhạt đi
PTHH: 5SO2 + 2KMnO4 + 2H2O → K2SO4 + 2MnSO4 + 2H2SO4
Trong đó: KMnO4 là Kali pemanganat, K2SO4 là Kali Sunfat, MnSO4: Mangan Sunfat
Cách 3: Sử dụng dung dịch H2S: Sản phẩm thu được là bột màu vàng
PTHH: SO2 + 2H2S → 3S↓ + 2H2O
Cách 4: Dùng dung dịch I2: Khí SO2 làm dung dịch I2 nhạt màu vàng
PTHH: SO2 + I2 + 2H2O → H2SO4 + 2HI
Cách 5: Dùng dung dịch Ca(OH)2 dư: SO2 sẽ làm cho nước vôi trong bị vẩn đục
PTHH: SO2 + Ca(OH)2 → CaSO3↓ + H2O
4. Hướng dẫn phân biệt giữa SO2 và CO2
Cách 1: Dùng thuốc tím [KMnO4] hoặc Br2
Để phân biệt SO2 và CO2 nên dùng thuốc thử là chất có tính Oxi hóa mạnh như thuốc tím [KMnO4] hoặc Brom Br2. Vì trong 2 khí, thì chỉ có khí SO2 là có tính khử nên sử dụng chất oxi hóa sẽ nhận biết được khí này.
Do số oxi hóa của lưu huỳnh trong SO2 đang ở +4. Do đó, nó có thể nhường 2 electron để xuất hiện cho quá trình oxi hóa. Trong khi đó, khí CO2 với số oxi hóa của cacbon (C) đang ở mức cao nhất là +4. Vì vậy, CO2 không thể làm mất màu thuốc tím được
![Dùng thuốc tím [KMnO4] hoặc Br2](https://chatdochai.net/wp-content/uploads/2023/01/dieu-che-so2-3.jpg)
5SO2 + 2KMnO4 + 2H2O —–>2H2SO4 + K2SO4 + 2MnSO4
khí SO2 làm mất màu của dung dịch nước Brom Br2, phương trình như sau:
SO2 + Br2 + 2H2O —–> H2SO4 + 2Hbr
Cách 2: Dùng cánh hoa hồng để phân biệt CO2 và SO2
Để phân biệt 2 chất này mà không dùng thuốc thử, ta có thể sử dụng cánh hoa hồng để nhận biết chúng.
Khí SO2 được biết như một chất khử mạnh khi số oxi hóa của lưu huỳnh (S) đang ở mức +4 có thể lên đến mức cao nhất+6 khi thích hợp. Cánh hoa hồng chứa chất red rose pigment chính đóng vai trò làm yếu tố quan trọng để thay đổi số oxi hóa của S. Chất này tạo nên màu đỏ cho cánh hoa hồng. Khi gặp khí SO2, chúng sẽ nhanh chóng bị oxi hóa biến thành dạng reduced pigment có màu trắng.
Thông qua quan sát hiện tượng chúng ta dễ dàng nhận ra được đâu là khí SO2. Và khí CO2 đặc biệt không làm mất màu cánh hoa hồng.
Có thể nói SO2 là một chất độc, gây ô nhiễm môi trường không khí. Tuy nhiên nó vẫn được sản xuất thường xuyên để phục vụ mục đích công nghiệp, là một trong những mắt xích quan trọng. Trên đây chúng tôi đã giải thích cho bạn đọc cách điều chế SO2 trong phòng thí nghiệm cụ thể nhất. Hãy theo dõi chúng tôi để cập nhật các kiến thức thường xuyên hơn nhé.