Amoniac là một hóa chất khá phổ biến và gắn liền với đời sống. Nó được sử dụng khá nhiều trong ngành công nghiệp. Bên cạnh đó hợp chất này cũng sẽ ảnh hưởng lớn đến sức khỏe của con người nếu không biết cách sử dụng. Vậy thì hãy cùng bài viết dưới đây tìm hiểu rõ hơn về hợp chất hóa học này nhé!
Amoniac là gì?
Trong hóa học, amoniac là một hợp chất vô cơ. Cấu tạo của nó bao gồm 3 nguyên tử Nitơ và 1 nguyên tử Hidro. Đây là một liên kết kém bền có công thức là NH3. Bên cạnh đó, hợp chất này có tính ăn mòn cao ở dạng đậm đặc nên được đánh giá là khá nguy hiểm. Vì thế, khi sử dụng hay lưu trữ nó đều cần phải kiểm soát nghiêm ngặt.
Cấu tạo phân tử của Amoniac
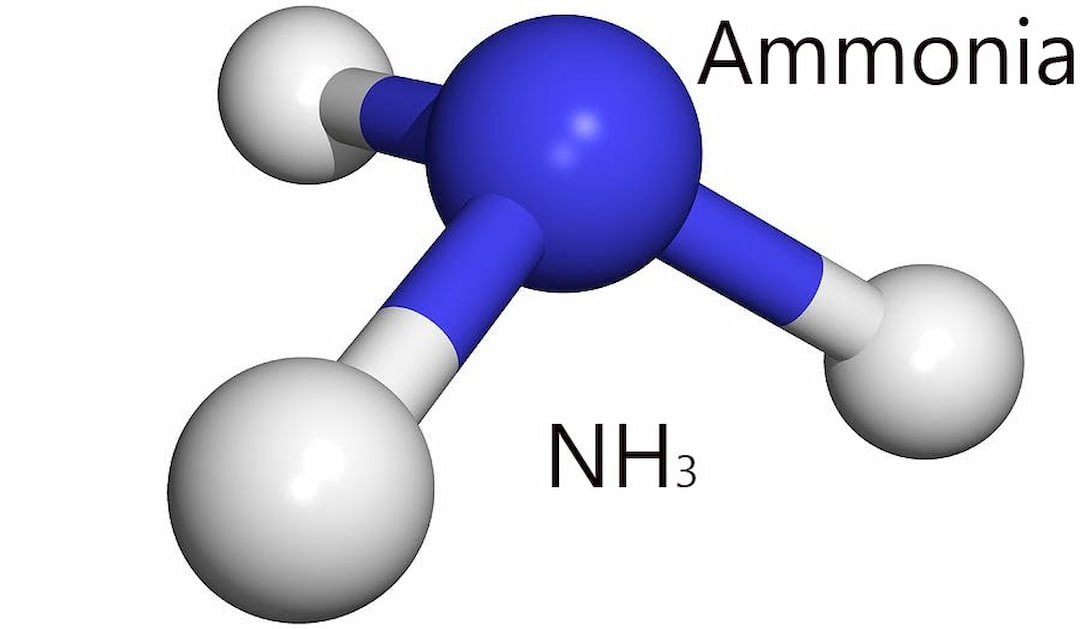
Amoniac có cấu tạo theo hình chóp với 3 liên kết H ở đáy và nguyên tử Nitơ ở trên chóp. Các liên kết này đều là những liên kết cộng hóa trị phân cực. Nguyên tử Nitơ dư điện tích âm và nguyên tử Hidro dư điện tích âm.
Tính chất cơ bản của NH3 như thế nào?
Amoniac sở hữu tính chất riêng để có thể phân biệt với những hợp chất khác. Dưới đây là tính chất vật lý và hóa học của NH3 mọi người nên ghi nhớ.
Tính chất vật lý
Những tính chất vật lý quan trọng của NH3 đó là:
- NH3 ở điều kiện tiêu chuẩn là một chất khí độc, có mùi hôi, khó chịu và tan rất nhiều nhiều ở trong nước
- Liên kết hóa trị của amoniac không bền vững nên có độ phân cực lớn. Hợp chất này ở dạng khí nhưng rất dễ bị hóa lỏng.
- Đây là một dung môi có thể trung hòa được các kim loại như Ba, Sr, Ca và những hợp chất có tính kiềm.
- Trong điều kiện môi trường bình thường NH3 rất dễ bị phân hủy.
Tính chất hoá học của Amoniac
Dưới đây là một vài tính chất hóa học đặc trưng của NH3:
- Amoniac có tính thử: Có thể tác dụng Oxi, Clo và một số oxit kim loại.
- NH3 có thể bị phân hủy dưới nhiệt độ cao, phản ứng hóa học của nó là: NH3 = N2 + 3H2.
- Tác dụng với ion kim loại tạo thành một ion phức: 2NH3+ Ag+ → [Ag(NH3)2]+
- Tác dụng dễ dàng với kim loại và H trong NH3 dễ dàng bị thay thế bởi kim loại nhôm hoặc kiềm: NH3 + Na → NaNH2 + H2.
- Khí Amoniac có thể tác dụng với muối với phương trình hóa học: NH3 + AlCl3 +H20 → Al(OH)3 + NH4Cl.
- NH3 có tính bazơ yếu
- Tính bazơ của NH3 yếu: Có thể tác dụng với axit tạo thành muối amoni.
- Dung dịch amoniac tác dụng với nhiều hidroxit kim loại tạo thành kết tủa.
Amoniac được tìm thấy ở đâu?
Amoniac được tìm thấy ở mọi nơi xung quanh chúng ta. Trong tự nhiên hợp chất này được sinh ra do sự phân hủy của các hợp chất hữu cơ từ thực vật hoặc động vật. Ngoài ra, nó còn tồn tại ở trong khí quyển với một lượng khá ít.
Chúng ta còn có thể tìm thấy NH3 ở trong nước biển và sau khi núi lửa phun trào. Trong các vùng khoáng chứa soda cũng tìm thấy tinh thể amoni bicacbonat. NH3 sẽ xuất hiện trong hoạt động bài viết hàng ngày của con người và động vật. Ở trong thận qua đường nước tiểu sẽ sản sinh ra một ít khí amoniac.
Ngoài ra, trong các nhà máy sản xuất phân ure sẽ tạo ra một ít NH3. Hoặc trong phản ứng hóa lỏng khí N2và H2 ở nhiệt độ từ 400 đến 450 với áp suất 200 đến 300 atm cũng xuất hiện amoniac lỏng.

Chất NH3 có độc hại hay không?
Amoniac là một hợp chất động hại và có thể gây hại đến sức khỏe của con người nếu ở nồng độ cao. Khi nó xâm nhập vào cơ thể khí NH3 sẽ tác dụng với nước sinh ra amoni hydroxit. Hợp chất tạo thành có thể làm tổn thương và ăn mòn tế bào trong cơ thể.
Một số nguy hiểm từ Amoniac
Dưới đây là một số nguy hiểm có thể gây ra khi bạn tiếp xúc phải một lượng amoniac nồng độ cao:
- Mũi: Khó kiểm soát và chảy nước mũi không ngừng.
- Họng: Cảm thấy đau rát và khó nuốt. Nghiêm trọng hơn thì sẽ gây nên hiện tượng bong lớp niêm mạc và bỏng phần miệng hầu. Nó còn có thể gây nên tắc nghẽn hô hấp, ho ra máu và đờm.
- Môi: Amoniac gây gây rát và sưng môi.
- Hệ hô hấp: Khiến con người bị khó thở gấp, khó thở, ho và thở khò khè. Nguy hiểm có thể gây nên hiện tượng đau thắt ngực, tức ngực, tắc nghẽn ống thở và co thắt thanh quản.
- Mắt: Xuất hiện tình trạng nhảy nước mắt liên tục, mắt sẽ bị đau rát và viêm kết mạc. Amoniac còn có thể khiến cho mắt bạn gặp phải tình trạng mù tạm thời.
- Hệ tim mạch: Mạch yếu dần, tim đập nhanh và xuất hiện hiện tượng đau tim lâm sàng, bị sốc và co thắt tim.
- Hệ thần kinh: Amoniac gây nên hiện tượng đau đầu, không thể điều khiển được hành động của cơ thể, đi lại khó khăn. Nặng hơn thì sẽ căng thẳng, bị sốt và có thể mất ý thức và hôn mê.
- Hệ tiêu hóa: Nhẹ thì sẽ buồn nôn, đau dạ dày. Nếu nặng thì gây nên nôn mửa, nôn ra máu, dạ dày bị bỏng rát rất dữ dội.
- Da: Trở nên tím tái. Khi tiếp xúc lâu thì da sẽ bị viêm, đỏ da và amoniac có thể gây bỏng ở nhiều cấp độ.
Cách sơ cứu khi ngộ độc Amoniac
Như vậy, amoniac thực sự rất độc hại và có ảnh hưởng lớn đến sức khỏe của mọi người. Do đó chúng ta phải biết cách sơ cứu khi không may trúng phải khí độc này. Khi biết mình ngộ độc khí NH3 bạn cần phải:
- Di chuyển đến những địa điểm an toàn hơn và cởi bỏ lớp quần áo bị dính phải khí độc. Hãy dùng khẩu trang hoặc khăn ấp để che phần mặt giảm thiểu lượng khí bị hấp thụ vào cơ thể.
- Nhanh chóng rửa sạch những vùng cơ thể có dính amoniac bằng nước hoặc nước muối.
- Khi da của bạn có dấu hiệu kích ứng thì cần phải nhanh chóng đi đến trung tâm y tế gần nhất để kịp thời xử lý.
- Khi bạn nuốt phải amoniac thì phải nới cổ áo và súc miệng liên tục bằng nước. Không được cố nôn và không dùng các loại nước có ga hay nước muối sẽ làm cho tình trạng càng thêm nguy hiểm.
- Những trường hợp khó thở, thở gấp, sốc, mù tạm thời sẽ rất nguy hiểm. Do đó cần phải đi gặp bác sức ngay lập tức. Nếu hôn mê thì cần phải tiến hành hô hấp nhân tạo để bệnh nhân tỉnh táo.
- Khi phát hiện ra khu vực rò rỉ hoặc nhiễm độc khí amoniac thì hãy liên hệ với các cơ quan chức năng để khắc phục hậu quả.

Điều chế Amoniac ra sao chuẩn xác?
Amoniac trong tự nhiên thường có lẫn nhiều loại hợp chất khác nhau. Do đó để sử dụng nó và ứng dụng trong cuộc sống thì cần phải điều chế. Dưới đây là các phương pháp để tạo nên NH3.
Trong phòng thí nghiệm
Trong phòng thí nghiệm, amoniac được điều chế bằng cách cho tác dụng muối amoni và kiềm. Thông thường người ta sẽ sử dụng muối NH4Cl và kiềm Ca(OH)2. Quá trình này có phương trình hóa học như sau:
Ca(OH)2 + 2NH4Cl = NH3 + CaCl2 + H2O
Trong công nghiệp
Amoniac có thành phần chính là hidro và azot liên kết với nhau. Hydro sẽ thu được từ nước còn azot thu được từ không khí. Azot và hidro sẽ được đem đi sấy khô, hâm nóng rồi nén ở nhiệt độ 530 độ. Sau đó sẽ cho hỗn hợp qua liên kết muối. Sau đó amoniac sẽ được tạo thành.
Bởi vì NH3 nặng hơn nửa không khí nên chúng ta cần phải nén và làm lạnh để thành dạng lọng. Sau khi nén khí sẽ bay hơi và hấp thụ nhiệt. Vì thế người ta sẽ dùng hợp chất này ở trong tủ lạnh. Trong công nghiệp NH3 được sản xuất với 5 công nghệ sau:
- Haldor Topsoe
- M.W. Kellogg
- Krupp Uhde
- Brown & Root.
Ứng dụng của Amoniac là gì?
Bên cạnh mang đến nhiều nguy hiểm của sức khỏe của con người thì amoniac cũng cực kỳ hữu ích. Ứng dụng của hợp chất này bao gồm:
Trong sinh hoạt
Trong sinh hoạt amoniac được sử dụng để:
- Chế xuất các chất tẩy rửa như chất tẩy bồn cầu, bột giặt. NH3 được ứng dụng trong quá trình xử lý chất bẩn.
- NH3 trở thành nguyên liệu trong quá trình xử lý và dọn dẹp nước thải, bùn thải công nghiệp.
- Làm chất tẩy rửa linh kiện điện tử và các thiết bị bán dẫn.
- Amoniac hỗ trợ quá trình kiểm soát độ pH của nước và quá trình xử lý nước thải.
- Làm chất tẩy rửa đối với những vết bẩn có tính axit. Nó sẽ làm sạch bề mặt dính bẩn một cách nhanh chóng.

Trong công nghiệp
Trong công nghiệp, amoniac được ứng dụng rất rộng rãi và đa dạng, Nó sử dụng nhiều trong quá trình khai thác mỏ, chế xuất dầu, dệt vải, xử lý môi trường và làm thuốc nhuộm. Cụ thể:
- Với tính trung hòa cao amoniac sẽ giúp loại bỏ các tạp chất có trong dầu thô. Điều này sẽ bảo vệ các thiết bị lọc dầu không bị ăn mòn và đảm bảo cho chất lượng dầu đạt tiêu chuẩn.
- NH3 được sử dụng nhiều trong ngành công nghiệp khai thác các loại kim loại như Niken, Đồng, molypden từ các quặng thô.
- Dung dịch amoniac sẽ được sử dụng trong các phòng thí nghiệm và nó phục vụ cho các nghiên cứu về hóa học và sinh học.
- Trở thành một nguyên liệu rất cần thiết trong ngành công nghiệp xử lý rác thải để loại bỏ NOx và SOx có trong khí thải đốt cháy các loại hóa thạch.
- Amoniac được ứng dụng trong ngành dệt để sản xuất các loại sợi tổng hợp. Nó có vai trò rất quan trọng trong quá trình làm sạch các vật liệu may mặc và quá trình nhuộm.
- Sử dụng trong công nghệ sản xuất nước giải khát và công nghệ thực phẩm. Nó là môi trường để các nấm men, vi sinh vật có lợi tồn tại. Amoniac cũng rất cần thiết trong quá trình sản xuất các loại dược phẩm.
Cách bảo quản Amoniac an toàn?
Bởi vì có thể gây nên nguy hiểm nên việc bảo quản amoniac cần phải đảm bảo an toàn và cẩn thận. Khi bảo quản NH3 mọi người cần phải:
- Đựng trong những bình chứa và bồn lỏng có ghi nhãn rõ ràng.
- Các bình chứa amoniac không thể nạp quá 80% thể tích của bình chứa.
- Đặt tại những nơi thoáng mát, khô ráo và tránh xa những nơi có thể gây cháy nổ.
- Tránh những vật tương khắc, tránh độ ẩm và tránh nhiệt.
Kết luận
Như vậy, toàn bộ thông tin về amoniac đã được cập nhật đầy đủ và chi tiết. Hy vọng mọi người sẽ sử dụng hợp chất này an toàn.