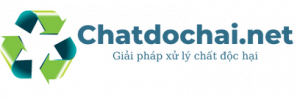Axit sunfuric hay còn có tên gọi khác là H2SO4 và nó có biệt danh là chúa tể trong những loại hóa chất hiện nay. Nó đóng vai trò chủ đạo cho ngành công nghiệp hiện nay. Ngành công nghiệp được tồn tại và phát triển cho đến hiện nay cũng là nhờ nó. Vậy nó có thật sự có công dụng quan trọng như vậy không? Hãy đến với nội dung bài viết sau để có được câu trả lời nhé!
Axit sunfuric được định nghĩa là gì?
Một trong những câu hỏi rất phổ biến nhất hiện nay mà chúng tôi nhận được rất nhiều đó chính là axit sunfuric là gì? Và câu trả lời là axit sunfuric là một axit có công thức là H2SO4. Nó được tồn tại dưới dạng là một chất lỏng không mùi, không bay hơi và đặc biệt là nó không có màu sắc.
Ngoài ra đây còn là một loại axit rất mạnh, được sử dụng chủ yếu và đóng vai trò quan trọng trong ngành công nghiệp, hoặc để làm chất xúc tác trong hóa học bằng các phản ứng. Ở bất cứ nơi nào bạn cũng có thể tìm thấy nó một cách dễ dàng.
Trong đó dễ nhận biết nhất và dễ tìm thấy nhất đó chính là nước mưa. Nếu bạn bị dính nước mưa và có cảm giác nóng rát, khó chịu thì đó là do tác dụng của nó. Cho đến hiện nay thì vẫn chưa có nhà khoa học nào tìm kiếm được mẫu axit sunfuric tinh khiết có ở trên Trái Đất.
Nó chỉ được tồn tại dưới dạng chất lỏng và trong đó nó chứa rất nhiều hợp chất từ những chất khác nhau. Và như vậy H2SO4 tinh khiết chỉ được điều chế từ những chất hóa học có phản ứng với nhau tạo thành.
Theo vật lý thì H2SO4 có tính chất gì?
Như đã nói ở trên, H2SO4 đặc hay lỏng đều có điểm chung là tồn tại ở thể lỏng, không màu, không mùi, không vị. Axit sunfuric lỏng có đặc điểm là rất khó để bay hơi và nó sẽ tan vô hạn khi ở trong nước.
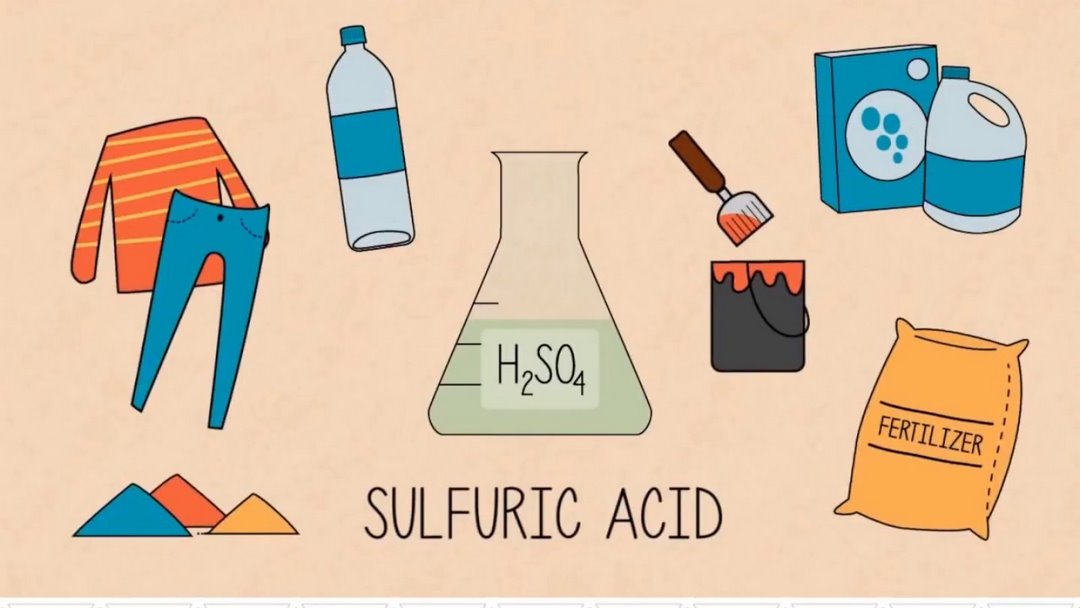
H2SO4 đặc nổi bật với khả năng hút nước và tỏa nhiệt mạnh. Vì vậy, bạn chú ý không được cho nước vào axit mà chỉ cho axit vào nước. Để hạn chế được tình trạng bạn sẽ bị bỏng khi cho nước phản ứng trực tiếp với axit. Và H2SO4 cũng có thể được pha loãng để trở thành H2SO4 loãng.
Axit sunfuric sẽ có tính chất hóa học như thế nào ?
Đối với axit sunfuric loãng thì đây chính là một axit rất mạnh, vì vậy nó có tất cả các tính chất hóa học của một axit thông thường. Điển hình như là đổi màu giấy quỳ thành đỏ, hay nó sẽ phản ứng với những bazơ, kim loại, muối và oxit axit để tạo thành những hợp chất hóa học.
Đối với H2SO4 đặc thì axit sunfuric đặc có tính chất hóa học tương tự như axit sunfuric loãng. Ngoài ra, nó còn có một số đặc tính nổi bật cụ thể là khi phản ứng với kim loại, cho đồng (Cu) vào dung dịch sẽ cho màu xanh lam. Tuy nhiên H2SO4 cũng có đặc tính hút nước rất mạnh. Ví dụ, đổ H2SO4 vào bát đựng đường trắng, sau vài phút nước sẽ chuyển sang màu đen và tràn ra ngoài.
Điều chế axit sunfuric (H2SO4)
Thông thường, việc điều chế axit sunfuric không được thực hiện trong phòng thí nghiệm vì nó rất nguy hiểm. Trong công nghiệp, người ta sẽ pha trộn theo chu trình sau: FeS2 hoặc S → SO2 → SO3 → H2SO4.
- Bước 1: Đầu tiên, bạn sẽ cần đốt cháy quặng pirit sắt: 4FeS2 + 11O2 → 8SO2 + 2Fe2O3.
- Bước 2: Sau đó oxi hóa SO2 bằng oxi ở điều kiện 400 đến 5000C, xúc tác V2O5: 2SO2 + O2 → 8SO3.
- Bước 3: H2SO4 đặc hấp thụ SO3 tạo thành oleum với công thức tổng quát là H2SO4.nSO3: nSO3 + H2SO4 → H2SO4 .nSO3.
- Bước 4: Pha loãng oleum thành axit sunfuric H2SO4 với một lượng nước thích hợp: (n+1) H2O + H2SO4 .nSO3 → (n + 1) H2SO4.
Axit sunfuric nguyên chất là một chất phân cực có hệ số điện môi xấp xỉ 100. Các phân tử của H2SO4 có thể proton hóa lẫn nhau, tạo ra tính dẫn điện của điện cực. Quá trình này còn được gọi là quá trình di chuyển proton.
Axit sunfuric H2SO4 có những dạng axit nào?
Mặc dù có thể tạo ra 100% axit sunfuric, nó sẽ mất SO3 ở điểm sôi để tạo ra axit 98,3%. Tùy vào mục đích sử dụng khác nhau mà người ta sử dụng nồng độ của axit sunfuric cụ thể là:
- Axit sunfuric loãng ở nồng độ 10% thường được sử dụng trong phòng thí nghiệm.
- H2SO4 nồng độ 33,5% được sử dụng cho pin.
- Được dùng để sản xuất phân bón với hàm lượng axit sunfuric là 62,18%.
- Với nồng độ axit sunfuric chiếm 77,67% được sử dụng trong tháp sản xuất hoặc axit tới hạn.
- Nồng độ 98% là axit ở dạng đậm đặc.

Trong đời sống thì H2SO4 có những ứng dụng gì?
Axit này còn là một trong những hóa chất hàng đầu được sử dụng trong công nghiệp như một nguyên liệu thô hoặc chất xúc tác chính. Đây chính là loại hóa chất được sử dụng phổ biến nhất trong sản xuất hóa học, sản xuất phân bón, chất tẩy rửa, chất dẻo, hay màu sơn,…
Trong sản xuất phân bón
Axit sunfuric được sử dụng chủ yếu trong sản xuất axit photphoric, một nguyên liệu không thể thiếu để sản xuất phân lân. Và nó cũng được sử dụng để sản xuất ra những hợp chất amoni sunfat.
Lĩnh vực công nghiệp – Axit sunfuric đóng vai trò chủ chốt
H2SO4 được sử dụng nhiều trong sản xuất kim loại như đồng, kẽm,… và dùng để làm sạch bề mặt sắt thép, dung dịch tẩy rỉ sét. Axit này còn được dùng để sản xuất nhôm sunfat (phèn giấy), muối sunfat, thuốc nổ, thuốc nhuộm, chất dẻo, tẩy rửa kim loại trước khi xi mạ, sản xuất dược phẩm.
Hỗn hợp H2SO4 với nước được dùng làm chất điện phân dưới dạng acquy, axit chì,… Hàng năm sử dụng khoảng 160 triệu tấn H2SO4, nổi bật trong các ngành sản xuất như phân bón, chất tẩy rửa 30%, giặt 14%, giấy, sợi 8%, nhựa 5%, luyện kim 2%, thuốc nhuộm 2%,…
Quy trình xử lý nước thải
Axit sunfuric được sử dụng để sản xuất nhôm hydroxit, để lọc được những tạp chất của những nhà máy xử lý nước nhằm để cải thiện mùi vị của nước, trung hòa độ pH trong nước, loại bỏ Ca2 +, Mg2 + là những chất thải có trong nước.
Lưu ý về tác hại của nó thì đây là hợp chất nguy hiểm bậc 1, có tính ăn mòn và làm phồng rộp da của chúng ta. Vì vậy, khi sử dụng cần trang bị đầy đủ các dụng cụ chuyên dụng, mặt nạ phòng độc cá nhân, khẩu trang, tủ hút khi pha chế,…
Phòng thí nghiệm
H2SO4 là một hóa chất rất đậm đặc, nó được sử dụng để điều chế các axit khác yếu hơn nó như là HNO3 hay HCl trong thí nghiệm. Nó là một chất hóa học không thể thiếu trong các phản ứng để đưa ra kết quả và ứng dụng trong các lĩnh vực khác của cuộc sống.
Một số ứng dụng khác cũng sử dụng Axit sunfuric
Sản xuất Al2(SO4)3 còn được gọi là phèn giấy. Hợp chất này có thể phản ứng với một lượng xà phòng rất nhỏ trên sợi bột giấy để tạo ra một nhóm cacboxylat dạng sền sệt, giúp sợi bột giấy dính chặt vào bề mặt cứng của giấy.
Những cách bảo quản và lưu ý khi sử dụng H2SO4
Như chúng ta đã biết H2SO4 được sử dụng khá nhiều trong đời sống. Tuy nhiên, H2SO4 cũng là một loại hóa chất nguy hiểm, có thể gây bỏng, thậm chí tử vong nếu tiếp xúc trực tiếp hoặc vô tình bắn vào người. Vì vậy, khi sử dụng cần tuyệt đối tuân thủ những lưu ý sau để đảm bảo an toàn cho chính mình:
- Mang găng tay dày, tiêu chuẩn.
- Khi tiếp xúc với hóa chất thì bạn nên mặc đầy đủ các phụ kiện để bảo hộ.
- Khi sử dụng phải đeo kính và đội mũ đầy đủ.
- Không đi dép, chân trần khi sử dụng H2SO4, nên đi giày hoặc ủng bảo hộ lao động.
- Tuyệt đối không xử lý nó trên băng ghế trống.
- Tuyệt đối không được đổ axit ra khỏi bình chứa.
- Không bao giờ mở pipet bằng miệng.
- Thực hiện chính xác theo những chỉ dẫn được ghi trên các nhãn dán của hóa chất.
- Không bao giờ đổ nước trực tiếp vào bình chứa để làm sạch.
- Không đổ H2SO4 vào hệ thống thoát nước thải chung.
- Khi đun nóng H2SO4 sẽ giải phóng ra SO2 và SO3, đây là những khí rất độc, có thể phải đeo khẩu trang nếu đun axit với lượng lớn.
Lưu ý về cách bảo quản, vì axit sunfuric là một axit cực kỳ mạnh, vì vậy chúng nên được bảo quản tránh ở những nơi ở xa khu vực để bazơ và các chất khử của nó. Đồng thời nó còn là một chất ăn mòn rất mạnh ngay khi nó đã pha loãng thì nó cũng sẽ ăn mòn rất nhiều kim loại như nhôm và sắt.
Cách bảo quản và phòng ngừa chính xác
Trong quá trình bảo quản hóa chất, để tránh trường hợp đáng tiếc hóa chất axit sunfuric thải ra môi trường. Và phản ứng với các chất khác gây nguy hiểm, ô nhiễm, cần lưu ý những vấn đề sau:
- Bảo quản H2SO4 trong thùng phuy nhựa hay bồn nhựa.
- Không sử dụng hộp kim loại để bảo quản, vì axit mạnh sẽ oxy hóa và ăn mòn kim loại.
- Đậy nắp thật chặt và bảo quản nơi thoáng mát khô ráo, tránh tiếp xúc trực tiếp ánh nắng mặt trời.
- Không lưu trữ gần bazơ hoặc chất khử.
- Tránh đựng chung với kim loại nặng, kim loại nhẹ, các chất có tính axit như HCl, Axit nitric, Axit photphoric, rất nguy hiểm.
Ngoài ra bạn nên có những biện pháp phòng ngừa phù hợp để bảo vệ bản thân. Cụ thể như mặt đầy đủ đồ bảo hộ khi điều chế hóa chất hay khi không có sự hướng dẫn của những người có chuyên môn cao thì tuyệt đối không được phép điều chế .
Để hạn chế được những tình trạng xấu như khi con người tiếp xúc H2SO4. Hoặc khi ăn phải axit sẽ gây tổn thương các cơ quan nội tạng do lượng lớn Axit bị phân hủy. Nếu lượng Axit đưa vào quá nhiều, nạn nhân sẽ tử vong gần như ngay lập tức do hoại tử thanh quản – khí quản.

Kết luận
Trên đây là những thông tin quan trọng về axit sunfuric để giải đáp những thắc mắc mà bạn đang lo lắng. Hy vọng với bài viết này của chúng tôi bạn sẽ nhận ra được mức độ nguy hiểm của nó như thế nào. Nếu không cần thiết thì bạn không nên sử dụng nó vì nó rất nguy hiểm đến tính mạng nếu bạn không cẩn thận.