Clo là một trong những chất có nhiều ứng dụng thực tế và thường gặp trong Hóa vô cơ. Vì thế, lý thuyết về tính chất hóa học của Clo, công thức hóa học của Clo cũng như cách điều chế và ứng dụng của chất này được thầy cô chú trọng truyền tải một cách chi tiết và tỉ mỉ trong các bài học trên lớp. Để giúp các em củng cố cũng như biết thêm một số thông tin liên quan đến chủ đề này, chúng tôi đã tổng hợp và chia sẻ đến các em bài viết dưới đây.

Tính chất vật lý của clo
Khí clo là chất khí mùi hắc, có màu vàng lục, nặng gấp 2,5 lần không khí và tan được trong nước, tan nhiều trong dung môi hữu cơ. Nó là một chất phổ biến trong tự nhiên và là chất cần thiết để tạo ra phần lớn các loại hình sống, trong đó có cả con người.
– Ở 20 °C, 1 thể tích nước hòa tan được 2,5 thể tích khí clo.
– Tỉ khối của oxi đối với không khí: dCl2/kk = 71/29.
– Clo có nhiệt độ nóng chảy là -101,5 °C và nhiệt độ sôi là -34,04 °C.
– Clo hóa lỏng dưới áp suất 8 bar ở nhiệt độ phòng.
– Clo là một halogen và có độ âm điện đứng thứ 3 trong tất cả các nguyên tố.
– Clo là một chất khí độc.
Tính chất hóa học của Clo
Tính chất hóa học của Clo là một trong những tính chất quan trọng nhất của chất rắn. Chúng được sử dụng trong nhiều lĩnh vực khác nhau, bao gồm cả công nghệ sinh học, hóa học, và công nghệ thực phẩm. Clo là một chất rắn có một số tính chất hóa học đặc biệt. Nó có khả năng kết hợp với các chất khác trong môi trường hóa học, cũng như có khả năng tạo ra các hợp chất hóa học phức tạp. Nó cũng có khả năng tạo ra các hợp chất có cấu trúc phức tạp, cũng như có khả năng tạo ra các hợp chất có cấu trúc đơn giản.
Clo cũng có khả năng tạo ra các hợp chất có khả năng hấp thụ ánh sáng, cũng như có khả năng tạo ra các hợp chất có khả năng hấp thụ nhiệt. Nó cũng có khả năng tạo ra các hợp chất có khả năng hấp thụ điện, cũng như có khả năng tạo ra các hợp chất có khả năng hấp thụ động lực. Ngoài ra, Clo còn có khả năng tạo ra các hợp chất có khả năng hấp thụ âm thanh, cũng như có khả năng tạo ra các hợp chất có khả năng hấp thụ điện trường.
Dưới đây là một số tính chất hóa học của Clo mà các em cần ghi nhớ trong chương trình Hóa vô cơ cấp 3.
Tác dụng với kim loại
Đầu tiên, Clo có khả năng cho phản ứng với hầu hết các kim loại (trừ Au và Pt) ở điều kiện nhiệt độ để tạo thành các muối halogenua. Muối thu được thường ứng với hóa trị cao nhất của kim loại tham gia phản ứng.
Phương trình phản ứng tổng quát:
2M + nCl2 → 2MCln
Ví dụ:
2Na + Cl2 → 2NaCl
Tác dụng với nước
Trong chương trình Hóa cấp 3, tính chất hóa học của Clo khi phản ứng với nước là tính chất hóa học phổ biến. Cụ thể, một phần Clo khi tan trong nước sẽ tạo thành hỗn hợp 2 axit là axit clohiđric và axit hipoclorơ. Trong phản ứng này, ta có thể khẳng định được rằng, Clo vừa đóng vai trò chất khử, vừa đóng vai trò chất oxi hóa.
Cl2 + H2O ⇌ HCl + HClO
Tác dụng với hidro
Trong phản ứng của Clo với khí hidro, sản phẩm thu được là hidro clorua. Khí hidro clorua được tạo thành này dễ tan trong nước và không màu.
Tác dụng với dung dịch kiềm
Clo có khả năng tác dụng với dung dịch kiềm loãng, nguội hoặc đặc nóng để tạo ra các sản phẩm khác nhau. Cụ thể, một số ví dụ về phương trình phản ứng cho từng trường hợp sẽ được viết như sau:
- Nếu dung dịch kiềm loãng, nguội:
Cl2 + NaOH loãng, nguội → NaCl + NaClO +H2O
- Nếu là dung dịch kiềm đặc nóng
Tác dụng với muối Halogen
Tính chất hóa học của Clo trong chương trình Hóa vô cơ cấp 3 cũng giới thiệu đến khả năng tác dụng với các muối halogen khác của Clo. Clo sẽ đẩy được brom và iot ra khỏi muối bromua và iotua (nhưng không đẩy được muối florua).
Cl2 + 2NaBr → 2NaCl + Br2
Tác dụng với hợp chất hữu cơ
Clo cũng sẽ cho phản ứng thế, phản ứng cộng hoặc phản ứng phân hủy với một số hợp chất hữu cơ.
CH4 + Cl2 → CH3Cl + HCl
CH2=CH2 + Cl2 → CH2Cl-CH2Cl
C2H2 + Cl2 → 2C + 2HCl
Tác dụng với các chất có tính khử
Cuối cùng, một tính chất hóa học của Clo quan trọng không kém khác mà các em cần ghi nhớ đó là Clo tác dụng với các chất có tính khử.
H2S + Cl2 → 2HCl + S
Cl2 + SO2 + 2H2O → H2SO4 + 2HCl
Cách điều chế Clo

Có 2 cách để điều chế Clo, đó là điều chế trong phòng thí nghiệm và trong công nghiệp. Cụ thể, các phản ứng sẽ diễn ra như sau:
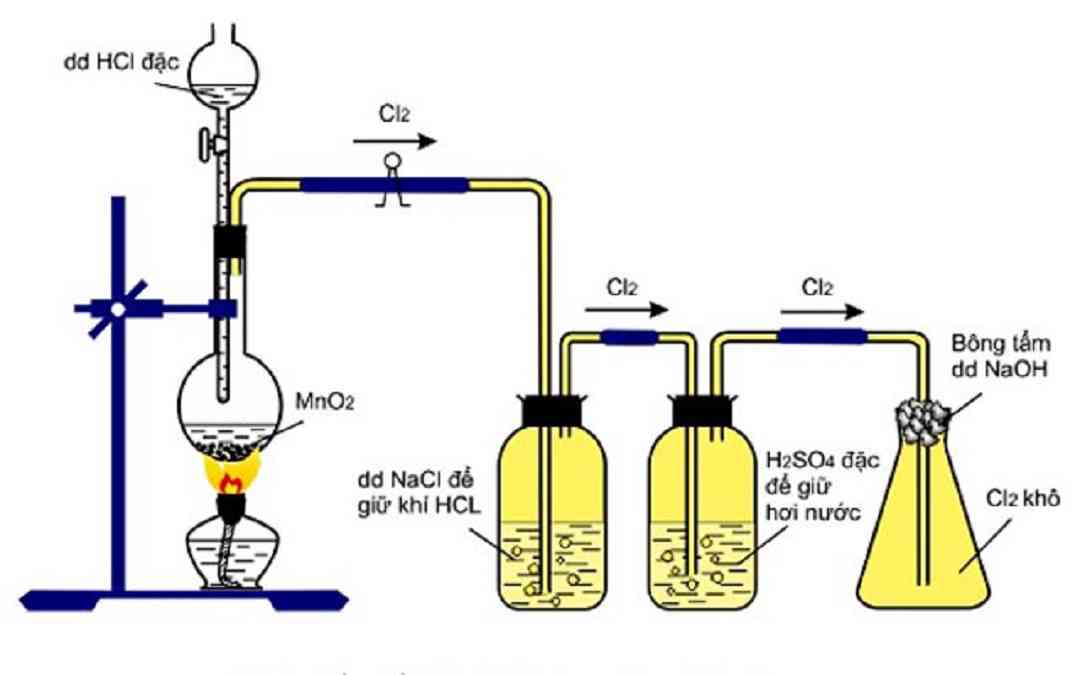
Trong phòng thí nghiệm
MnO2 + 4HCl → MnCl2 + Cl2 + H2O
2KMnO4 + 16HCl2 → MnCl2 + 2KCl + 5Cl2 + 8H2O
Trong công nghiệp
Dùng phương pháp điện phân NaCl có màng ngăn xốp với điện cực dương bằng than chì và điện cực âm làm bằng sắt để điều chế Clo trong công nghiệp.
2NaCl + 2H2O(đpdd) → 2NaOH + H2 + Cl2
Kết luận
Clo là một hóa chất có tính chất đặc biệt và có nhiều ảnh hưởng đến môi trường. Nó có thể gây ra nhiều hậu quả không tốt cho sức khỏe con người và môi trường. Tính chất hóa học của Clo không phải là dạng kiến thức khó. Hy vọng sau khi đọc xong bài viết, các em sẽ thu thập được nhiều thông tin bổ ích xoay quanh chủ đề này.